- Tiếp cận điều trị vi khuẩn gram âm đa kháng: Cập nhật IDSA (2021) 26/03/2022, 21:09
- Viêm ruột kết màng giả và điều trị Clostridium difficile trên người lớn 26/03/2022, 20:42
- Danh mục thuốc Bệnh viện Bình Dân năm 2021 16/02/2022, 14:29
- Bản tin thuốc số 02/2021 16/02/2022, 14:11
- Bản tin thuốc số 01/2021 09/02/2022, 16:45
- Thông tin thuốc Bản tin số 01/2020 Bệnh viện Bình Dân 15/01/2020, 11:00
- THÔNG TIN THUỐC_BẢN TIN SỐ 02/2018 17/09/2018, 09:44
- Thông tin thuốc_Bản tin số 02/2017 26/09/2017, 09:24
Tăng thanh thải thận trên bệnh nhân ICU
Tổng quan
Tăng thanh thải thận (Augmented Renal Clearance - ARC) - tăng cường thải trừ các chất tan trong tuần hoàn chung qua thận - là một biểu hiện lâm sàng với độ thanh thải creatinine trong 24 giờ lớn hơn 130 mL/phút/1,73 m2 ghi nhận ở những bệnh nhân nặng [1]. Mặc dù có thể đã tồn tại lâu trước nhưng phải đến đầu những năm 2010, khái niệm ARC mới được đưa vào trong thực tế điều trị. Sự tăng thanh thải thận đối với thuốc trong thời gian biểu hiện ARC có thể tác động đáng kể đến kết quả điều trị của bệnh nhân. Việc sử dụng chế độ liều thường qui mà không hiệu chỉnh theo chức năng thận hiện tại ở bệnh nhân ARC có thể dẫn đến thất bại điều trị [2].
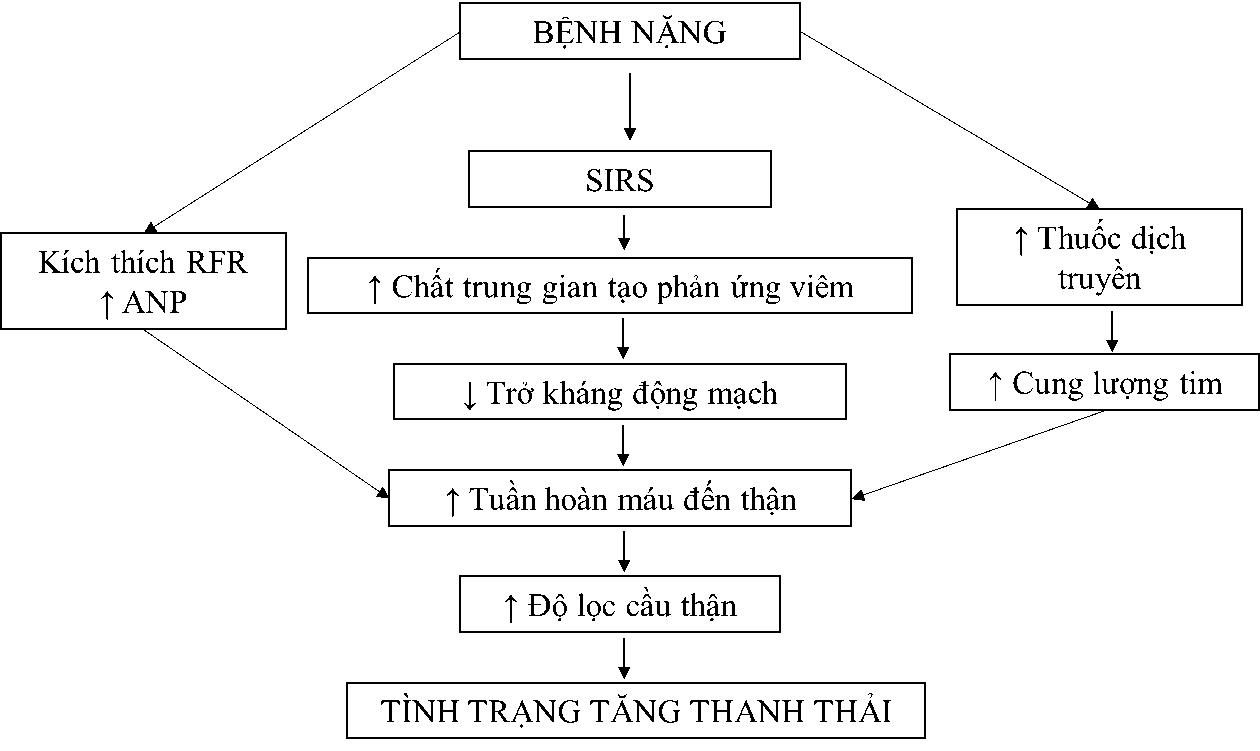
Nguyên nhân dẫn đến tình trạng tăng thanh thải ở bệnh nhân nặng vẫn chưa được xác định chính xác nhưng ARC được cho là có mối liên quan mật thiết đến hội chứng đáp ứng viêm hệ thống (SIRS)[1]. Bệnh nặng có thể hoạt hóa SIRS[2] và dự trữ chức năng thận (RFR), dẫn đến tăng tuần hoàn máu thận và tăng độ lọc cầu thận. Ngoài những biến đổi về mặt sinh lý thì việc phải sử dụng thuốc đường tiêm truyền và các biện pháp duy trì chức năng tim mạch bao gồm bồi phụ thể tích tuần hoàn và sử dụng thuốc giãn mạch[3] ở bệnh nặng có thể làm tăng cung lượng tim; kèm với sự gia tăng nồng độ peptid natri lợi niệu tâm nhĩ (ANP) cũng góp phần làm tăng tuần hoàn máu thận[4]. Các yếu tố này làm tăng độ lọc cầu thận, dẫn đến tình trạng tăng thanh thải ở bệnh nhân nặng (Hình 1.1) [2, 5].
Hình 1.1. Cơ chế tăng thanh thải thận ở bệnh nhân ICU
Tình trạng tăng thanh thải thường được xem là một dấu hiệu tốt vì chứng tỏ cơ thể vẫn còn khả năng đáp ứng với tổn thương. Dù vậy cần chú ý đến các thuốc đào thải qua thận, ví dụ các kháng sinh nhóm βeta-lactam, Aminoglycoside, thuốc kháng đông Enoxaparin,…
Thang điểm đánh giá nguy cơ tăng thanh thải
Các nghiên cứu dịch tễ học về tình trạng tăng thanh thải thận ở bệnh nhân nặng cho thấy tình trạng này xuất hiện nhiều hơn ở bệnh nhân trẻ (trung vị 43 tuổi so với 61 tuổi, p = 0,023), giới tính nam (75,6% so với 46,7%, p = 0,014), vừa trải qua sang chấn (phẫu thuật, chấn thương), và có mức điểm đánh giá bệnh nặng thấp (ví dụ: thang điểm SOFA, SAPS, APACHE II). ARC có mối tương quan chặt chẽ với bệnh nhân chấn thương và nhiễm khuẩn huyết giai đoạn đầu với tỉ suất mắc được ghi nhận lần lượt là 85,7% và 50-85% [3].
Ngoài ra, hội chứng ARC còn liên quan đến việc sử dụng noradrenalin (p = 0,01), lượng muối nạp (p < 0,0001), huyết áp động mạch trung bình (p = 0,0002), và áp lực tĩnh mạch trung tâm (p = 0,02). Một số yếu tố khác cũng được cho là ảnh hưởng đến ARC như: nồng độ creatinine huyết thanh thấp (0,7 mg/dl so với 0,8 mg/dl, p = 0,001), vóc dáng cơ thể: BMI (23,6 mg/kg2 so với 22,1 mg/kg2, p < 0,05), bệnh lý đái tháo đường (11,6% so với 25%, p < 0,05), albumin huyết thanh cao (4,2 g/dl so với 3,8 g/dl, p <0,05) [6].
Cho đến nay có 2 thang điểm đánh giá nguy cơ tăng thanh thải: thang điểm ARC và thang điểm ARTIC [2] (Bảng 1.1).
Bảng 1.1. Đánh giá nguy cơ xuất hiện tăng thanh thải thận
|
Thang điểm ARC |
Thang điểm ARCTIC |
|
|
Yếu tố nguy cơ |
Tuổi ≤ 50 = 6 điểm Chấn thương = 3 điểm Điểm SOFAa ≤ 4 = 1 điểm |
SCrb < 62 µmol/L = 3 điểm Giới nam = 2 điểm Tuổi < 56 = 4 điểm Tuổi 56 - 75 tuổi = 3 điểm |
|
Đánh giá nguy cơ |
0 - 6 điểm: nguy cơ ARC thấp 7 - 10 điểm: nguy cơ ARC cao |
< 6 điểm: nguy cơ ARC thấp ≥ 6 điểm: nguy cơ ARC cao |
|
Độ nhạy |
100% |
84% |
|
Tính đặc hiệu |
71% |
68% |
|
Chú thích: aSOFA (Sequential Organ Failure Assessment): Đánh giá suy chức năng đa cơ quan bSCr: nồng độ creatinin huyết thanh |
||
Thang điểm ARC đã được chứng minh độ nhạy là 100% và độ đặc hiệu là 71% trong chẩn đoán bệnh nhân mắc ARC[5] [7]. Nhưng vì tính không thực tế cần phải hoàn thành điểm SOFA trong hệ thống tính điểm ARC, Barletta et al. đã đề xuất hệ thống tính điểm Chăm sóc đặc biệt sau chấn thương (ARCTIC), mặc dù phương pháp này chỉ đạt độ nhạy 84% và độ đặc hiệu là 68% [6]. Việc sử dụng các công cụ dự đoán ARC hoặc ARCTIC cho phép xác định sớm các bệnh nhân có nguy cơ và giúp các bác sĩ thực hiện các biện pháp can thiệp thích hợp.
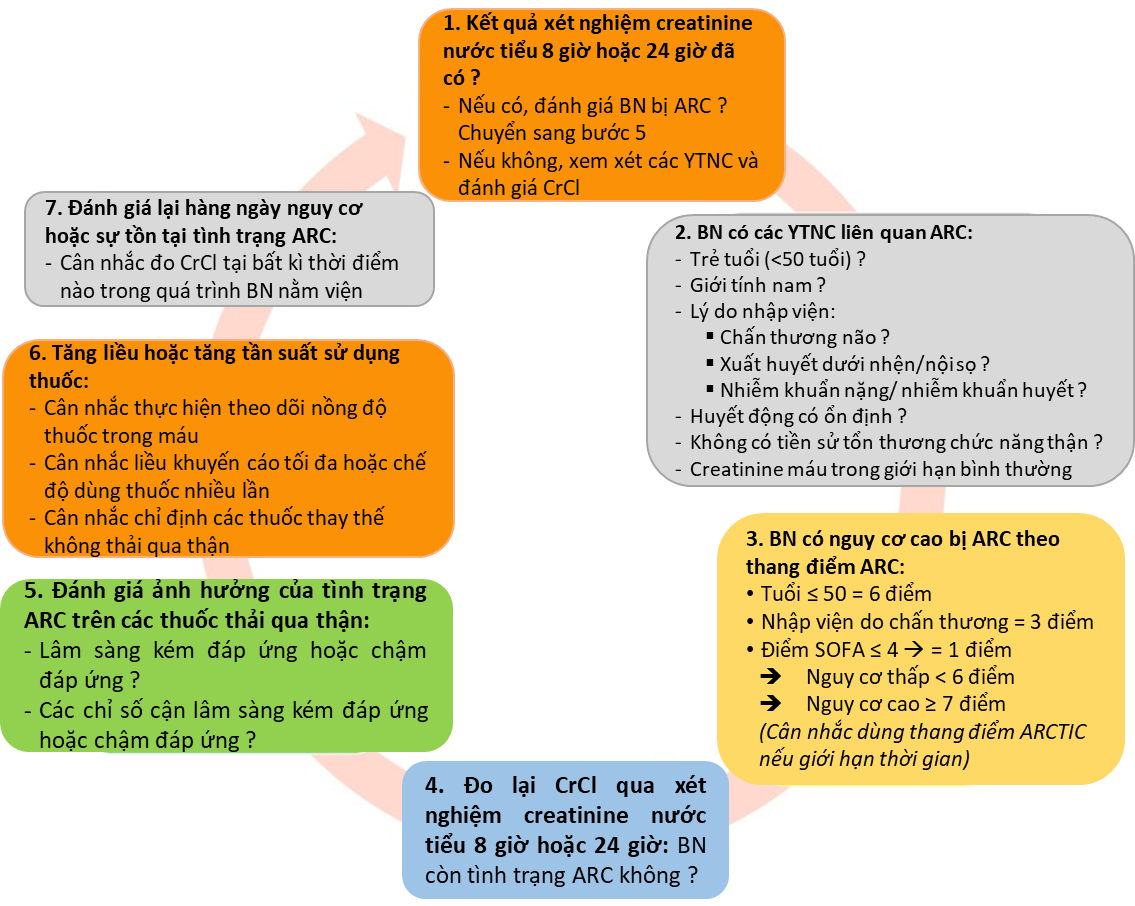
Xác định và tầm soát ARC ở bệnh nhân ICU (Hình 1.2)
“Tiêu chuẩn vàng” để đánh giá chức năng thải trừ của thận là xác định mức lọc cầu thận (GFR) sử dụng các chất ngoại sinh như: inulin, Cr-EDTA, iohexol…; nhưng việc sử dụng các marker như vậy khá tốn kém và phức tạp nên không được áp dụng thường quy trên lâm sàng. Đo độ thanh thải creatinine thông qua nồng độ creatinine niệu trong khoảng thời gian xác định là phương pháp ước tính khá chính xác (chỉ sau đo GFR bằng chất ngoại sinh), dễ thực hiện, ít tốn kém và thích hợp cho bệnh nhân nặng [2, 8]. Tuy nhiên, phương pháp này có hạn chế là cần tiến hành trong điều kiện ổn định trong khi bệnh nhân ICU lại có huyết động thận dao động nhanh, thể tích dịch cơ thể thay đổi liên tục [9]. Ngày nay, các phương pháp đánh giá chức năng thận thông dụng nhất là sử dụng các công thức ước tính GFR dựa trên nồng độ creatinine huyết thanh (CrCl) như Cockcroft-Gault, MDRD, CKD-EPI, Jelliffe's & Jelliffe's multistep. Các công thức này đều có độ lệch chấp nhận được nhưng phản ánh thiếu chính xác chức năng thận thực tế[6]. Do đó, khuyến cáo phát hiện và đánh giá ARC nên dựa vào việc đo CrCl thông qua nồng độ creatinine niệu.
Định nghĩa của tăng thanh thải ở bệnh nhân nặng hiện nay được chẩn đoán với mức CrCl > 130 mL/phút/1,73 m2. CrCl24h hiệu chỉnh theo diện tích cơ thể được tính như sau:
Có 3 mức thời gian được đưa ra để lấy mẫu nước tiểu: 8, 12, 24 giờ. Việc lấy mẫu nước tiểu trong khoảng thời gian ngắn (2 giờ) có thể giảm sai số lấy mẫu, hoàn thành trong ngày và phù hợp với bệnh nhân có chức năng thận thay đổi liên tục, nhưng khung thời gian lấy mẫu phải được lựa chọn tùy theo sự thay đổi thải trừ trong ngày. Thanh thải thận tính theo creatinine nước tiểu 24 giờ lại không mang ý nghĩa thực tiễn trên nền bệnh nặng với diễn tiến nhanh và phức tạp. Nhiều nghiên cứu cho thấy creatinine nước tiểu 8 giờ (cùng áp dụng công thức như trên) cho kết quả có độ chính xác tốt nhất tương đồng với creatinine nước tiểu 24 giờ[7] [10]. Do đó creatinine nước tiểu 8 giờ thường được chọn để xác đinh CrCl niệu.
Tối ưu hóa chế độ liều thuốc ở bệnh nhân ARC
Tầm quan trọng lâm sàng của ARC chủ yếu liên quan đến việc tăng cường đào thải thuốc, dẫn đến nồng độ dưới trị liệu và có khả năng thất bại trong điều trị. Đối với thuốc được sử dụng để đạt được hiệu quả lâm sàng mong muốn (ví dụ như thuốc hạ huyết áp và thuốc an thần), có thể dễ dàng sửa đổi liều khi có ARC. Tuy nhiên, đối với các loại thuốc có các chỉ số đánh giá không rõ ràng, như kháng sinh và hậu quả của liệu pháp dưới mức tối ưu có thể dẫn đến tai biến lớn, cần phải sớm xem xét ước tính độ thanh thải của thuốc để dùng liều thuốc chính xác.
Hiệu chỉnh liều trên bệnh nhân có nguy cơ ARC cao cần hướng tới cá thể hóa điều trị trên cơ sở cân nhắc giữa lợi ích và nguy cơ thiếu liều thuốc hoặc độc tính tiềm ẩn. Ảnh hưởng này rất lớn đối với các thuốc thải trừ chủ yếu qua thận, điển hình là vancomycin (80-90% thuốc thải trừ dưới dạng không đổi qua thận) và kháng sinh phụ thuộc thời gian như nhóm βeta-lactam (xem thêm Bảng 1.2).
- Vancomycin: ngày càng có nhiều bằng chứng cho thấy liều vancomycin thông thường không đạt được nồng độ đáy mục tiêu 15-25 mg/L trong điều trị ở những bệnh nhân ARC, đồng thời nghiên cứu đã ghi nhận AUC0-24h giảm rõ rệt ở bệnh nhân này [2]. Không những thế ngay cả khi đã dùng vancomycin liều cao (> 2 g/ngày) thì vẫn có nghiên cứu ghi nhận 100% bệnh nhân ARC không đạt được nồng độ đáy mục tiêu sau 3 ngày sử dụng vancomycin [11]. Tỷ lệ tử vong ở những bệnh nhân này cao hơn đáng kể so với những bệnh nhân đạt được mức nồng độ đáy trị liệu (OR = 2,1, p = 0,003) [12].
Nhiều chế độ liều vancomycin khác nhau đã được đề xuất và thử nghiệm trên bệnh nhân ARC. Nhìn chung, liều trung bình để đạt được mức nồng độ đáy mục tiêu là 42 mg/kg/ngày và có thể tăng lên đến 44 mg/kg/ngày. Theo đó, liều nạp 25 mg/kg, liều duy trì là 40 mg/kg/ngày cho chức năng thận CrCl >130 mL/phút. Nghiên cứu của Baptista và cộng sự đã ghi nhận 84% bệnh nhân ARC đạt được mức nồng độ đáy mục tiêu 25 mg/L với chế độ liều vancomycin sử dụng độ thanh thải creatinin đo 8 giờ [2].
- βeta-lactam là nhóm kháng sinh phụ thuộc thời gian nên tối ưu hóa chế độ liều dựa theo PK/PD của thuốc sẽ tập trung vào việc truyền liên tục/kéo dài thời gian mỗi lần truyền thuốc hoặc tăng số lần truyền thuốc trong ngày. Trong trường hợp bệnh nặng có chức năng thận thay đổi, việc sử dụng phác đồ truyền liên tục cố định có thể vẫn không đảm bảo đạt đích PK/PD mục tiêu. Do đó, cần tăng tổng liều kháng sinh để làm tăng thời gian trên nồng độ ức chế tối thiểu (T > MIC) đảm bảo tối ưu hóa hiệu quả điều trị.
- Aminoglycosid là nhóm kháng sinh phụ thuộc nồng độ và được thải trừ chủ yếu qua thận nên cần phải theo dõi nồng độ thuốc trong huyết thanh và điều chỉnh liều.
- Fluoroquinolon (FQ) cũng là một nhóm kháng sinh bị ảnh hưởng bởi sự thay đổi độ thanh thải của thận. Do thuốc có thời gian bán thải dài nên ở bệnh nhân bình thường hoặc suy giảm chức năng thận, không cần thiết thực hiện TDM. Tuy nhiên, việc theo dõi nồng độ thuốc FQ có thể có giá trị ở bệnh nhân ARC và cân nhắc phải dùng liều cao hơn[8].
Bảng 1.2. Liều dùng kháng sinh gợi ý ở bệnh nhân nặng có ARC [2, 13]
|
Kháng sinh |
Liều dùng gợi ý |
Ghi chú |
|
Amikacin |
20mg/kg mỗi 24 giờ |
|
|
Ceftazidime |
4-6g mỗi 24 giờ, TTM liên tục |
|
|
Cefepime |
4-6g mỗi 24 giờ, TTM liên tục hoặc 2g mỗi 8 giờ, TTM kéo dài trong 3 giờ |
|
|
Ciprofloxacin |
600mg mỗi 12 giờ hoặc 400mg mỗi 8 giờ |
|
|
Imipenem |
500mg mỗi 4 giờ hoặc 250mg mỗi 3 giờ, TTM liên tục trong 3 giờ |
|
|
Levofloxacin |
750-1000mg mỗi 24 giờ |
Liều levofloxacin 1000mg mỗi 24 giờ cho hiệu quả cao trong điều trị S. pneumoniae, P. aeruginosa và S. aureus. |
|
Meropenem |
2g mỗi 8 giờ |
Có thể tăng liều đến 8g/ngày |
|
Piperacillin/tazobactam |
4,5g mỗi 6 giờ, TTM kéo dài trong 4 giờ |
TTM liên tục 24 giờ có thể không cải thiện kết quả lâm sàng |
|
Teicoplanin |
Liều tải 12mg/kg mỗi 12 giờ trong 3-4 liều; liều duy trì 6mg/kg mỗi 12 giờ |
|
|
Vancomycin |
Liều tải 25-30 mg/kg, liều duy trì 45 mg/kg/ngày, chia làm mỗi 8 giờ hoặc TTM liên tục |
Có thể tăng liều đến 44 mg/kg/ngày hoặc 47 mg/kg/ngày ở bệnh nhân nặng 70kg và CrCl 150mL/phút |
DS. Ninh Thị Hoa Hường
Tài liệu tham khảo
1. A Udy, A., et al., ARC-augmented renal clearance. Current pharmaceutical biotechnology, 2011. 12(12): p. 2020-2029.
2. Mahmoud, S.H. and C. Shen, Augmented renal clearance in critical illness: an important consideration in drug dosing. Pharmaceutics, 2017. 9(3): p. 36.
3. Hobbs, A.L., et al., Implications of Augmented Renal Clearance on Drug Dosing in Critically Ill Patients: A Focus on Antibiotics. Pharmacotherapy, 2015. 35(11): p. 1063-75.
4. Udy, A.A., Augmented renal clearance in the critically ill: Prevalence, risk factors and implications for beta-lactam therapy. 2014.
5. Atkinson Jr, A.J., Augmented renal clearance. Translational and clinical pharmacology, 2018. 26(3): p. 111.
6. Barletta, J.F., et al., Identifying augmented renal clearance in trauma patients: validation of the augmented renal clearance in trauma intensive care scoring system. Journal of Trauma and Acute Care Surgery, 2017. 82(4): p. 665-671.
7. Akers, K.S., et al., Modified augmented renal clearance score predicts rapid piperacillin and tazobactam clearance in critically ill surgery and trauma patients. Journal of Trauma and Acute Care Surgery, 2014. 77(3): p. S163-S170.
8. Baptista, J.P., et al., Accuracy of the estimation of glomerular filtration rate within a population of critically ill patients. Journal of nephrology, 2014. 27(4): p. 403-410.
9. Sunder, S., et al., Estimation of renal function in the intensive care unit: the covert concepts brought to light. Journal of intensive care, 2014. 2(1): p. 1-7.
10. Wu, C.-C., et al., Augmented renal clearance is associated with inadequate antibiotic pharmacokinetic/pharmacodynamic target in Asian ICU population: a prospective observational study. Infection and drug resistance, 2019. 12: p. 2531.
11. Campassi, M.L., et al., Augmented renal clearance in critically ill patients: incidence, associated factors and effects on vancomycin treatment. Revista Brasileira de terapia intensiva, 2014. 26(1): p. 13-20.
12. Spadaro, S., et al., Evaluation of a protocol for vancomycin administration in critically patients with and without kidney dysfunction. BMC anesthesiology, 2015. 15(1): p. 1-7.
13. Pea, F. and P. Viale, Bench-to-bedside review: appropriate antibiotic therapy in severe sepsis and septic shock–does the dose matter? Critical Care, 2009. 13(3): p. 1-13.Liều levofloxacin 1g mỗi 24 giờ đã được đề xuất cho các bệnh nhiễm trùng do S. pneumoniae, P. aeruginosa và S. aureus ở bệnh nhân có CrCl >130 mL/phút (liều thông thường 0,5-0,75g mỗi 24 giờ). [8]
[7] Khi so sánh mức tương quan giữa CrCl 2h, CrCl 6h, CrCl 8h, CrCl 16h, CrCl Cockcroft-Gault với CrCl 24h ta được hệ số tương quan lần lượt là: 0,597; 0,760; 0,815; 0,958; 0,670.
[6] Cả 3 công thức Cockcroft-Gault, CKD-EPI, Hoek đều có độ đặc hiệu cao (lần lượt 81%, 91%, 91%) nhưng độ nhạy thấp (lần lượt 69%, 25%, 38%) khi xác định ARC.
[5] Dựa trên dữ liệu xác nhận từ dược động học của piperacillin/tazobactam đã thay đổi ở bệnh nhân ICU.
[4] Tuy nhiên, kết quả về mối tương quan giữa ANP và độ thanh thải creatinine không đạt được ý nghĩa thống kê.
[3] Ảnh hưởng của 2 yếu tố này vẫn cần được nghiên cứu thêm. Các dữ liệu lâm sàng gần đây cho thấy tác động của noradrenalin làm tăng cung lượng tim, lưu lượng máu tới thận và thanh thải thận, đặc biệt trong trường hợp có giãn mạch rõ rệt.
[2] Các chất trung gian gây viêm có thể làm tăng đáng kể cung lượng tim và giảm sức cản thành mạch, do đó làm tăng mức lọc cầu thận ở những bệnh nhân có chức năng thận bảo tồn.
[1] SIRS là một phần của đáp ứng miễn dịch gây ra nhiều rối loạn sinh lý ở bệnh nhân nặng. Nguyên nhân dẫn đến SIRS có thể là tình trạng nhiễm khuẩn nặng, chấn thương, bỏng, viêm tụy, phẫu thuật lớn, các bệnh lý tự miễn, viêm phổi thở máy, thiếu máu cục bộ, bệnh máu ác tính ….



 Tìm bác sĩ
Tìm bác sĩ Lịch khám bệnh
Lịch khám bệnh